
Presseseite Manajit Hayer-Hartl
Ein Protein aus dem Reagenzglas
Nur mit der korrekten Struktur können Proteine ihre Aufgaben in der Zelle erfüllen. Für die richtige Faltung sorgen „zelluläre Anstandsdamen“, die Chaperone. Sie können zudem dabei helfen, Proteine künstlich im Reagenzglas herzustellen. Manajit Hayer-Hartl und ihr Team konnten das Schlüsselprotein der Photosynthese nachbauen.
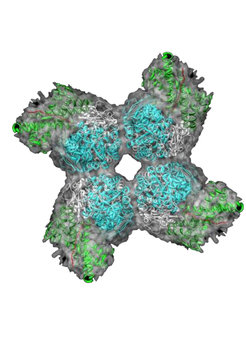
Proteine nehmen in der Zelle wichtige Aufgaben wahr. Zum Beispiel transportieren sie Stoffe, übermitteln Botschaften oder führen lebenswichtige Prozesse aus. Wie die Photosynthese: Pflanzen wandeln Kohlendioxid und Wasser in Sauerstoff und Zucker um. Das Schlüsselprotein in diesem Prozess nennen die Forscher Rubisco. Es bindet Kohlendioxid und erzeugt damit Zuckermoleküle als Baustoff für den Organismus. Somit ist Rubisco eines der wichtigsten Proteine überhaupt. Seine Aufgabe kann es jedoch nur erfüllen, wenn es die richtige Struktur aufweist.
Faltungshelfer im Einsatz
Rubisco besteht aus insgesamt 16 Untereinheiten. Diese komplexe Struktur machte es bisher unmöglich, eine funktionsfähige Version des Proteins im Reagenzglas nachzubauen. Manajit Hayer-Hartl nahm die Chaperone GroEL und GroES zur Hilfe: Sie sorgten dafür, dass die Untereinheiten von Rubisco die korrekte Faltung erhielten. Aus ihnen setzte das Helferprotein RbcX dann einen funktionierenden Rubisco-Komplex zusammen.
Leistungssteigerung im Sinne der Umwelt
In einem nächsten Schritt wollen die Wissenschaftler versuchen, dass künstlich hergestellte Rubisco-Protein zu verändern. Es soll effektiver Kohlendioxid umsetzen als sein natürliches Pendant, das auch häufig mit Sauerstoff reagiert. Da ein leistungsstärkeres Rubisco mehr Kohlendioxid aus der Atmosphäre binden würde, könnten die Arbeiten der Forscher auch von Interesse für den Klimaschutz sein.



