Molekulare Medizin
Forschungsbericht (importiert) 2003 - Max-Planck-Institut für Biochemie
Zelladhäsionsrezeptoren vermitteln die Anheftung von Zellen an die extrazelluläre Matrix und die Interaktion mit Nachbarzellen. Die Zelladhäsion ist wichtig für die Embryonalentwicklung und für den Verlauf von vielen Krankheiten, wie etwa bei der Wundheilung, Krebsmetastasierung und entzündlichen Erkrankungen. Integrine sind eine große und funktionell wichtige Gruppe von Zelladhäsionsrezeptoren, die extrazellulare Matrixproteine, wie zum Beispiel Kollagen, Laminin und Fibronektin binden. Integrine bestehen aus zwei verschiedenen Proteinketten (einer α und einer β Kette). Es gibt insgesamt 16 α und 8 β Ketten, die in unterschiedlichen Kombinationen mindestens 24 verschiedene Integrine bilden können. Zellbiologische und genetische Untersuchungen in der Maus, Fliege und beim Wurm haben gezeigt, dass Integrine neben der Adhäsion auch die Migration, das Wachstum und das Überleben von Zellen steuern. Diese Funktionen werden von Signal- und Adaptormolekülen vermittelt, die mit der zytoplasmatischen Domäne der Intgerine assoziieren und dabei einerseits chemische Signale erzeugen und andereseits die Integrine mit dem Akingerüst der Zelle verknüpfen.
Die Verknüpfung der Integrine mit dem Aktingerüst ist von zentraler Bedeutung für die Integrinfunktion. Nach Bindung der Integrine an die extrazelluläre Matrix wird Aktin mithilfe von Adaptoren, wie zum Beispiel Talin oder α-actinin, an die Integrine rekrutiert. Die Integrin-Aktin-Interaktion führt dann zu einer Aggregation der Integrine und zur Ausbildung von fokalen Adhäsionsstellen (focal adhesion sites, FAs) (Abb. 1). Die FAs sind Verankerungs- und Schaltstellen der Zelle, die nicht nur stabile Adhäsion garantieren, das Aktingerüst reorganisieren und Aktinfilamente an der Zellmembran verankern, sondern auch Integrin vermittelte Signale weiterleiten, um so Zellpolarität und gerichtete Zellwanderung, Zellwachstum und Überleben der Zellen zu regulieren.
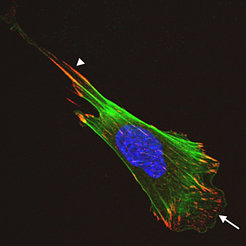
Die Wechselwirkungen zwischen den Integrinen und dem Aktingerüst sind dynamisch und sehr kurzlebig und werden in den verschiedenen Kompartimenten der Zelle unterschiedlich reguliert. An der Zellfront von wandernden Zellen zum Beispiel binden Integrine an Matrixproteine und lösen nach Aktivierung der Rho-GTPasen Rac1 und Cdc42 und ihrer Verankerung in der Zellmembran eine örtlich begrenzte Reorganisation des Aktingerüsts aus, die zu charakteristischen Ausdehnungen der Zellmembran (so genannte Fiolopodia und Lamellipodia) führt. Am hinteren Teil der Zelle wird die Anheftung der Integrine an die Matrix und die Verknüpfung mit dem Aktingerüst aufgelöst, was zu einer Ablösung der Zellmembran von der Matrixunterlage führt und nach Kontraktion eine Vorwärtsbewegung der Zelle ermöglicht.
Untersuchungen der Integrin-Matrix-Wechselwirkungen mit zellbiologischen Methoden und in verschiedenen Tiermodellen haben auf beeindruckende Weise gezeigt, dass Integrine während der Embryogenese, im Erwachsenenalter und bei Krankheiten entscheidende Funktionen ausüben. Integrine können mit einer Vielzahl von zytoplasmatischen Molekülen interagieren und viele verschiedene Signalketten aktivieren. Zellspezifisch stehen aber jeweils bestimmte Interaktionen und Mechanismen im Vordergrund.
Arbeitsgruppe Fässler
Analyse von Fibronektin und Perlecan in der Maus
In den vergangenen Jahren untersuchten wir die Funktion von Fibronektin und Perlecan, zwei prototypische Matrixproteine, die verschiedene Integrine, Wachstumsfaktoren und Matrixkomponenten binden. Zellbiologische Untersuchungen zeigten, dass Fibronektin die Adhäsion, Proliferation und das Überleben von Zellen steuert. Deletion des Fibronektingens in der Maus führt zum Absterben des Embryos kurz nach der Gastrulation. Um die embryonale Letalität zu umgehen, haben wir das Fibronektin-Gen spezifisch in Leberzellen ausgeschaltet und so eine Maus hergestellt, die kein Fibronektin im Blut (Plasma-Fibronektin) hat, aber normale Mengen in allen anderen Geweben. Mit dieser Mausmutante konnten wir zeigen, dass verschiedene, dem Fibronektin zugeschriebene Funktionen, wie zum Beispiel Verklumpung (Aggregation) der Blutplättchen bei Blutgerinnung und Zellwanderung während der Wundheilung der Haut in Abweseneheit von Plasma-Fibronektin normal ablaufen, aber andere Funktionen, wie das Überleben von Nervenzellen nach Hirnschlag, von Fibronektin abhängig sind. Perlecan (das mit langen Zuckerketten modifiziert wird) ist ein Bestandteil der Basalmembran, einer teppichartigen Struktur von verschiedenen Matrixproteinen, die allen Epithel- und Endothelgeweben unterliegt. Darüber hinaus ist es auch im Knorpelgwebe exprimiert. Tiere ohne Perlecan zeigen Defekte im Herz und Gehirn, die auf Grund einer defekten Basalmembran entsehen. Der Verlust von Perlecan im Knorpelgewebe führt zum proteolytischen Verlust von Knorpelkollagenen und schweren Skelettanomalien (Abb. 2). Zurzeit werden Mäuse mit Veränderungen in bestimmten Domänen und in den Integrinbindungsstellen hergstellt und analysiert, um die vielen Funktionen einer bestimmten molekularen Interaktion zuordnen zu können.
Analyse der β1-Integrinfamilie in der Maus
Die β1-Integrinfamilie besteht aus 12 Mitgliedern, die nach Deletion der β1-Kette nicht mehr exprimiert werden. Wir konnten zeigen, dass der Verlust dieser Integrine zu einem Absterben des Embryos kurz nach der Einnistung in den Uterus führt. Die Ursache liegt in einer abnormalen Expression von Laminin, nicht an einer defekten Proliferation oder einem verminderten Überleben von embryonalen Zellen. Spezifische Deletion der β-Familie in Blutstammzellen blockiert ihre Einwanderung in fötale Leber und das Knochenmark. Eine Deletion des β1-Integringens in der Haut wiederum führt zum Verlust der Haare (wahrscheinlich Migrationsdefekt der Haarstammzellen), Blasenbildung (Adhäsionsdefekt der Hautzellen), Proliferationsdefekt der Hautzellen und zu einer starken dermalen Fibrose. Diese Ergebnisse zeigen eindrucksvoll, dass Integrine eine gewebespezifische Funktion ausüben. In Zusammenarbeit mit der Gruppe Brakebusch werden zurzeit Bindungsstellen und funktionell wichtige Aminosäuren in der zytoplasmatischen Domäne des β1-Integrins in der Maus mutiert und deren Auswirkungen in der Haut untersucht.
Analyse des ILK/Pinch/Parvin Komplex
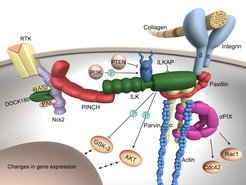
Aktivierte Integrine rekrutieren mit ihrer intrazelluären Domäne zytoplasmatische Proteine, mit denen sie spezifische Signalwege anschalten oder modulieren. Ein wichtiges β1-Integrin-assoziiertes Protein ist die Integrin-linked-Kinase (ILK) (Abb. 3). Zellbiologische Untersuchungen zeigten, dass ILK unter anderem PKB/Akt und GSK3 phosphoryliert und Adaptorproteine wie zum Beispiel Pinch und Parvin in die FAs rekrutiert. Mit der Phosphorylierung von PKB/Akt und GSK3 durch ILK glaubte man einen molekularen Mechanismus für die adhäsionsabhängige Zellproliferation und den Zelltod entdeckt zu haben. Wir konnten bei Mäusen, bei denen das ILK-Gen ausgeschaltet worden ist zeigen, dass der Verlust der ILK-Expression zu massiven Defekten des Aktingerüsts führt, die Phosphorylierung von PKB/Akt und GSK3 aber nicht verändert ist. Zurzeit werden Mutationen in der Kinasedomäne in vivo untersucht und Mäuse etabliert, denen die Adaptoren Pinch und Parvin fehlen.
Arbeitsgruppe Brakebusch
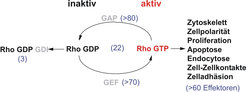
Die Reorganisation des Zytoskeletts ist von entschiedender Bedeutung für die Zellwanderung. Rho GTPasen wie zum Beispiel Cdc42, Rac1 oder RhoA regulieren diese Reorganisation und sind verantwortlich für die Extension und Polarisierung der Zelle in Wanderrichtung, die Kontraktion des Zellkörpers und die Ablösung des hinteren Zellteiles von der umgebenden Extrazellularmatrix. Darüber hinaus beeinflussen Rho GTPasen aber auch zahlreiche andere zelluläre Prozesse wie zum Beispiel Proliferation, Zelltod, Endozytose und Zell-Zell-Kontakte. Die Aktivität von Rho GTPasen wird durch viele externe Stimuli (z. B. Wachstumsfaktoren, Zell-Matrix-Kontakte, Zell-Zell-Kontakte) über mehr als 100 aktivierende (GEFs) und inaktivierende Proteine (GAPs) gesteuert und ist daher sowohl vom Zelltyp als auch vom Umfeld der Zelle abhängig (Abb. 4). Unsere Arbeitsgruppe untersucht die Funktion von Rho GTPasen auf molekularer und zellulärer Ebene und im lebenden Organismus, indem Mäuse mit gewebespezifischen Mutationen in Rho GTPase-Genen erzeugt und analysiert werden. Hierbei stehen die Haut und das hämatopoetische System im Mittelpunkt unseres Interesses. Neben der Funktion der Rho GTPasen während der Entwicklung, untersuchen wir ihre Aufgaben in Reparaturprozessen (z. B. Wundheilung) und in Krankheitsmodellen (z. B. Tumorentstehung).
In Keratinozyten ist Cdc42 wichtig für die Haarfollikelmorphogenese und den Erhalt der Zell-Zell-Kontakte. In Abwesenheit von Cdc42 kommt es zu einem erhöhten Abbau von β-Catenin und Plakoglobin, da die Aktivität einer den Abbau induzierenden Kinase, GSK3β, gesteigert wird. β-Catenin ist wichtig für die Induktion von Haarfollikel-spezifischen Genen im Zellkern, wo es zusammen mit Molekülen der LEF/TCF-Familie als Transkriptionsfaktor fungiert. An der Zellmembran sind β-Catenin und Plakoglobin an den Zell-Zell-Kontakten beteiligt. Hier führt der Verlust von β-Catenin und Plakoglobin zu einer reduzierten Membranlokalisation des Zelladhäsionsmoleküls E-Cadherin. Da β-Catenin eine wichtige Rolle in der Tumorgenese spielt, wollen wir jetzt die Auswirkungen des Verlustes von Cdc42 in Hauttumormodellen untersuchen. In Hepatozyten kommt es nach Deletion des Cdc42-Gens zu defekten Zell-Zell-Kontakten, zur Hyperproliferation und zur Bildung von Tumoren. Im hämatopoetischen System ist Cdc42 wichtig für die Lymphopoese. Diese Ergebnisse zeigen die zellspezifisch sehr unterschiedlichen Funktionen von Cdc42 und belegen die Bedeutung von genetisch veränderten Mäusen für das Verständnis der Aufgaben von Rho GTPasen im lebenden Organismus.
Arbeitsgruppe Sasaki
Unsere Gruppe beschäftigt sich mit Struktur-Funktionsbeziehungen bei Proteinen der extrazellulären Matrix, mit dem Schwerpunkt auf Basalmembran-Komponenten (Laminine, Nidogene, Perlecan, BM-40, Kollagen Typ XV und Kollagen Typ XVIII). Anhand rekombinant hergestellter Protein-Domänen untersuchen wir die Bindung an andere Matrixproteine und zelluläre Rezeptoren. Zusammen mit E. Hohenester (Imperial College, London) und J. Stetefeld (Biozentrum Basel) arbeiten wir an der Strukturanalyse der von uns hergestellten Domänen.
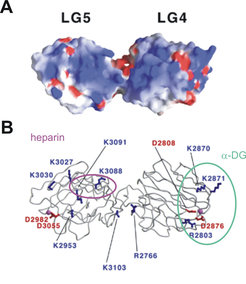
Seit einigen Jahren beschäftigen wir uns intensiv mit den LG-Modulen der Laminine. Diese Gruppe von Basalmembranproteinen ist sehr wichtig für den Aufbau der Struktur der Basalmembran und für die Wechselwirkung zwischen Matrix und Zellen. 15 verschiedene Lamininisoformen sind bisher bekannt. Sie entstehen durch Kombination verschiedener α (α1-α5), β (β1-β3) und γ (γ1-γ3) Ketten zu kreuzförmigen Molekülen, die über ein "coiled-coil" Strukturelement trimerisieren. Die α-Ketten enthalten 5 globuläre LG-Module (LG1-LG5) an ihrem C-terminalen Ende. Diese LG-Module enthalten Bindungsstellen für zelluläre Rezeptoren (Integrine, α-Dystroglycan und Syndecane) und für membranständige Kohlenhydratliganden, die wichtig für Zell-Matrix-Wechselwirkungen und die Synthese der Basalmembran sind. Kürzlich haben wir die Kristallstruktur des LG4-LG5-Tandems der Laminin α2-Kette aufgeklärt (Abb. 5). LG4-LG5 bindet Heparin, Sulfatide und α-Dystroglycan. Die Bindung an α-Dystroglycan ist besonders wichtig für die Muskelfunktion. Dystroglycan besteht aus einer stark glykosylierten extrazellulären Untereinheit (α-Dystroglycan) und einer Transmembran-Untereinheit (β-Dystroglycan), die sich mit anderen membrangebundenen Proteinen zum Dystrophin-Glykoprotein-Komplex (DGC) zusammenlagern. Im Menschen führen Mutationen in der α2-Lamininkette oder in Komponenten des DGC zu angeborenen muskulären Dystrophien. Mit der Röntgenstrukturanalyse der Tandems konnten wir zeigen, dass sich über das ganze LG4-LG5-Molekül eine basische Region erstreckt, die möglicherweise Bindungsstellen für das negativ geladene Heparin und α-Dystroglycan sowie 2 unvollständig koordinierte Kalziumionen enthält. Kalzium ist für die Funktion von α-Dystroglycan wichtig und wird vermutlich an negativ geladene Seitenketten gebunden. Ausgehend von der dreidimensionalen Struktur induzierten wir gezielt Punkmutationen im Laminin α2 LG4-LG5-Doppelmodul, um die Feinstruktur der α-Dystroglycan- und der Heparin/Sulfatidbindungsstelle zu kartieren. Die Hauptbindungsstelle für Heparin und Sulfatide liegt demnach auf LG5 und besteht aus den Lysinen 2953, 3030, 3088, 3091 und 3095. Eine Bindungsstelle mit schwächerer Affinität wurde in LG4 (Lysine 2870 und 2871) gefunden. Arginin 2803 und die Lysine 2870 und 2871 sowie die kalziumbindenden Asparaginsäuren 2808 und 2876 in LG4 sind wichtig für die α-Dystroglycanbindung während die Kalzium-Bindungsstelle auf LG5 keine Bedeutung für diese Interaktion hat. Während also die Bindungsstellen für Heparin und Sulfatide einerseits und α-Dystroglycan andererseits in der α2-Kette auf unterschiedlichen LG-Modulen liegen, binden diese Liganden in der Laminin α1-Kette ausschließlich an das LG4-Modul.
Arbeitsgruppe Moser
Unsere Arbeitsgruppe beschäftigt sich mit der Familie von AP-2-Transkriptionsfaktoren, die aus fünf Mitgliedern besteht und überwiegend während der Embryonalentwicklung in mesodermalen und ektodermalen Geweben gebildet werden. Inaktivierungen der Gene von AP-2α, β oder γ führen zum Tod der Maus während oder kurz nach der Embryonalentwicklung. Histologische Untersuchungen der Mutanten und zellbiologische Analysen zeigen, dass AP-2-Moleküle bei der Zelldifferenzierung eine Rolle spielen, aber auch den Zelltod unterdrücken. Dies erfolgt zum einen durch Induktion des Zellzyklusinhibitors p21 und durch Repression des cyclin D2-Gens, zum anderen durch Aktivierung von Wachstumsfaktoren und deren Rezeptoren und durch eine Hemmung der c-myc-induzierten Apoptose. Interessanterweise scheinen auch Tumore diese Eigenschaft von AP-2 als Überlebensfaktor zu nutzen.
Derzeit konzentrieren wir uns auf die Bedeutung von drei AP-2-Faktoren: AP-2β, AP-2δ und AP-2ε. AP-2β-Mausmutanten sterben auf Grund eines schweren Nierenschadens, der mit einem massiven Zelltod in den Nierentubulusepithelzellen und Zystenbildung einhergeht. Darüber hinaus weisen diese Mutanten Handanomalien auf. Vor kurzem wurden bei humanen Patienten Mutationen im AP-2β-Gen identifiziert. Patienten, die dieses als "Char-Syndrom" bezeichnete Krankheitsbild aufweisen, haben meist auch verkürzte oder fehlende Fingerglieder. Unsere Untersuchungen deuten darauf hin, dass AP-2-Transkriptionsfaktoren die Genexpression von BMP (bone morphogenic proteins)-Genen kontrollieren.
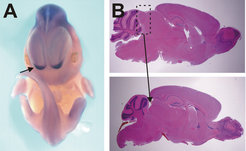
Während AP-2α, β und γ in vielen verschieden Geweben gebildet werden, findet man die beiden erst kürzlich identifizierten AP-2-Gene, AP-2δ und ε, fast ausschließlich im Nervensystem. AP-2δ wird dabei sehr stark im hinteren Teil des Mittelhirns gebildet, in dem keines der anderen AP-2-Moleküle exprimiert wird. Eine Inaktivierung von AP-2δ in der Maus ergab, dass exakt diese Struktur apoptotisch abstirbt, während andere Zellen, die neben AP-2δ noch andere AP-2-Typen exprimieren, überleben (Abb. 6). Dieser Befund deutet erneut auf die essentielle Funktion von AP-2-Proteinen für das Überleben von Zellen hin. Zurzeit untersuchen wir die molekularen Ursachen des Zelltods.
Schließlich wurde vor kurzem in unserer Abteilung ein neues, fünftes Mitglied der AP-2-Familie identifiziert, das besonders stark in Nervenzellen des Riechkolbens und im Vomeronasalen Organ exprimiert wird (Abb. 6). Dieses Organ ist für die Rezeption von sozialen und sexuellen Botenstoffen, so genannten Pheromonen, verantwortlich. Im Moment generieren wir Mausmutanten des AP-2ε-Gens.
Arbeitsgruppe Aszodi
Matriline sind Adaptorproteine der Extrazellularmatrix mit bislang unbekannter biologischer Funktion. Während alle bislang bekannten Matriline (Matrilin-1, -2, -3, -4) im Knorpel exprimiert werden, sind Matrilin-2 und Matrilin-4 auch außerhalb des Skelettsystems exprimiert. Um die Funktion von Matrilinen in vivo aufzuklären, haben wir murine Defektmutanten von Matrilin-1, -2 und -3 erzeugt und generieren zurzeit Matrilin-4 Mutanten. Überraschenderweise zeigen keine der Matrilin-Mutanten einen offensichtlichen Phänotyp, was auf eine funktionelle Redundanz zwischen den Proteinen schließen lässt. Unsere Hypothese wird durch die erst kürzlich erzielten Untersuchungen unterstützt, die eine zweifache Hochregulation der Matrilin-4-Expression in Matrilin-1 und -3 Doppelmutanten zeigen. Um die Frage der funktionellen Redundanz zu klären, werden derzeit in unserem Labor Mehrfachmutanten erzeugt. Alternativ versuchen wir, die Funktion von Matrilinen unter besonderen zellulären Stress-Bedingungen zu untersuchen und werden dazu Wundheilungsassays, Heilung von Knochenfrakturen oder Analysen von Geweben unter extremen mechanischen Belastungen untersuchen.





