Onkogenomanalyse zur Entwicklung von neuartigen Krebstherapien
Forschungsbericht (importiert) 2005 - Max-Planck-Institut für Biochemie
Zelluläre Signalübertragung
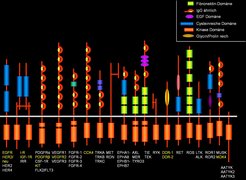
Die Phosphorylierung und Dephosphorylierung der Aminosäure Tyrosin in Zellproteinen durch spezifische Kinasen und Phosphatasen ist für viele biologische Vorgänge von zentraler Bedeutung. Die strukturelle und funktionelle Erforschung der molekularen Gundlagen der diesen Vorgängen zugrunde liegenden Signalprozesse begann mit der Klonierung und Charakterisierung der ersten Rezeptortyrosinkinase (RTK), dem EGF-Rezeptor, im Jahre 1984. Seither wurden mittels effizienter molekularbiologischer Klonierungsmethoden mehr als neunzig Tyrosinkinasen unterschiedlicher Strukturtypen identifiziert. Die Kategorie der RTKs ist nach einem gemeinsamen Organisationsprinzip aufgebaut: Sie enthalten alle eine glykosylierte extrazelluläre Ligandenbindungsdomäne, eine hydrophobe Membranankerregion und eine intrazelluläre Signaldomäne, welche die Tyrosinkinaseaktivität enthält (Abb. 1).
Die Aktivierung der enzymatischen Domäne erfolgt nach Bindung eines spezifischen Liganden, wodurch ein externer Stimulus in ein intrazelluläres Signal umgesetzt wird. Der erste Schritt zur Aktivierung der RTK-Signalfunktion erfolgt durch die Bindung des Liganden an die extrazelluläre Domäne des Rezeptors. Die dadurch hervorgerufene Konformationsänderung führt zur Dimerisierung zweier Rezeptormonomere und damit zur Aktivierung der intrinsischen Tyrosinkinase. Im Falle der heterotetrameren Typ II-Rezeptoren, wie dem Insulinrezeptor, bei denen αβ-Monomere bereits über Disulfidbrücken zu „Dimeren“ verbunden sind, löst die Ligandenbindung eine aktivierende Konformationsänderung aus. Kinetische Untersuchungen des EGF-Rezeptors haben gezeigt, dass die Dimerisierung einen essenziellen Schritt zur Kinaseaktivierung darstellt. Die dadurch ermöglichte Interaktion der Kinasedomänen zweier Rezeptormonomere führt vermutlich über eine intermolekulare Transphosphorylierung zur Phosphorylierung von Tyrosinresten im Rezeptor selbst. Der durch Transphosphorylierung aktivierte Rezeptor bindet nachfolgend spezifische zelluläre Proteine, wodurch eine intrazelluläre Signaltransduktionskaskade eingeleitet wird (Abb. 2).
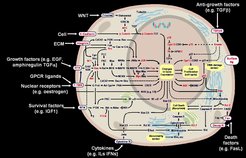
Viele dieser rezeptorassoziierenden Moleküle enthalten konservierte Bereiche, die eine spezifische Bindung an Phosphotyrosinreste vermitteln. Diese ungefähr 100 Aminosäuren umfassenden Abschnitte werden, da sie zuerst in der zytoplasmatischen Tyrosinkinase c-src identifiziert wurden, als src-Homologie-2-Domänen (SH2-Domänen) bezeichnet. Die Affinität der Bindung von SH2-Domänen wird dabei durch die den Phosphotyrosinrest flankierende Aminosäuresequenz bestimmt. Jede SH2-Domäne bindet daher nur an einen Phosphotyrosinrest in einem bestimmten Sequenzkontext, was die Interaktionsspezifität zwischen Substrat und Rezeptor definiert. Viele der spezifisch gebundenen Substrate werden vom Rezeptor wiederum tyrosinphosphoryliert und dadurch möglicherweise in ihrer enzymatischen Aktivität reguliert. Neben den SH2-Signalproteinen, die zusätzlich eine enzymatische Aktivität besitzen (z.B. Phospholipase Cγ, das GTPase-aktivierende Protein GAP, die Tyrosinkinasen scr, yes und fyn sowie die Tyrosinphosphatasen PTP1C und PTP1D), sind RTK-assoziierende Proteine bekannt, die nur SH2- und SH3-Domänen enthalten und als Adaptoren für katalytisch-aktive Proteine fungieren. In diese Molekülklasse gehören p85, die nichtkatalytische Untereinheit der P13 Kinase und die Adapterproteine GRB2, SHC, CRK und NCK. GRB2, das die Bindung des GDP/GTP Austauschfaktors SOS vermittelt, kann sowohl direkt als auch über SHC oder sogar PTP1D an RTKs binden und damit einen Signalweg aktivieren, der über ras, raf, MAP-Kinase-Kinase und MAP-Kinase in den Zellkern führt, wo über die Phosphorylierung von Transkriptionsfaktoren Genregulationsvorgänge beeinflusst werden. Die primären und sekundären Effekte solcher pleiotropen RTK-Signale führen letztlich zu Gesamtzellantworten wie Zellteilung, -differenzierung, -bewegung und –tod. Außerdem werden durch derartige Signale fundamentale metabolische Vorgänge gesteuert, die im Falle von Fehlfunktionen zu Stoffwechselkrankheiten wie Diabetes führen.
Um flexibel auf äußere Signale reagieren zu können, ist es für die Zelle entscheidend, dass die Aktivierung eines Rezeptors ein vorübergehendes Ereignis darstellt. Verschiedene Mechanismen in der Zelle sorgen dafür, dass der phosphorylierte Rezeptor wieder inaktiviert und so der Ausgangszustand wieder hergestellt wird. Eine zentrale Rolle nehmen dabei spezifische Protein-Tyrosinphosphatasen (PTP) als zelluläre Gegenspieler der RTKs ein. Diese PTPs, von denen mehr als 50 bekannt sind, können ebenfalls in verschiedene Strukturklassen gegliedert werden. Dazu gehören auch membranständige Formen, die möglicherweise eine Rolle bei den Zell/Zell- oder Zell/extrazelluläre Matrix-Interaktionen spielen, da sie häufig Charakteristika von Zelladhäsonsmolekülen aufweisen.
Biologische Funktion von Rezeptortyrosinkinasen
Die zentrale physiologische Bedeutung von Rezeptortyrosinkinasen tritt durch die schwer wiegenden Konsequenzen von Störungen in ihrer Regulation oder Funktion zu Tage. Überexpression kann unkontrolliertes Zellwachstum und Tumorbildung auslösen; so ist beispielsweise bei ca. dreißig Prozent aller Mamma-Karzinom Fälle die Rezeptortyrosinkinase HER2 abnormal hoch exprimiert. Ähnliche Folgen haben Mutationen, die zu konstitutiver Rezeptoraktivierung führen, wie das Beispiel des retroviralen v-erbB-Onkogenproduktes zeigt. Der mutierte EGF-Rezeptor, den das Hühner-Erythroblastosevirus (AEV) in infizierten Zellen exprimiert, verursacht in den Tieren Erythroblastose und Fibrosarkome. Auf der anderen Seite hat jedoch auch der Verlust oder die Beeinträchtigung der Funktion einer Rezeptortyrosinkinase weitreichende Folgen für den Organismus. So kann der Typ II Diabetes mellitus, der so genannte Insulin-unabhängige Diabetes, durch Mutationen des Insulin-Rezeptors verursacht werden.
Eine Hauptarbeitsrichtung der Abteilung hat die funktionelle Charakterisierung von RTKs und PTPs und die Untersuchung der biologischen Funktion dieser Signalregulatoren zum Gegenstand. Aktuell bearbeitete Forschungsthemen umfassen die negative Signalregulation durch PTPs und das Mitogen-induzierte Gen Mig6, den Mechanismus des EGFR Transaktivierungssignalwegs, die funktionelle und medizinische Bedeutung des weit verbreiteten FGFR4 Gen-Polymorphismus G388R und die physiologische Bedeutung der RTK Axl/Ufo in der Zellmigration und Tumormetastasierung. Weiterhin werden Gene, die an Mechanismen beteiligt sind, die zum programmierten Zelltod führen bzw. diesen verhindern (Anti-Apoptose), mittels einer in der Abteilung entwickelten Methode (Target Screen, TASC) identifiziert und auf ihre Eignung als Therapieentwicklungs-Zielstrukturen geprüft.
RTK-Signale in Krebszellen und Entwicklung von neuartigen Therapien
Im Prinzip besitzt jeder Rezeptor mit Tyrosinkinase-Aktivität ein onkogenes Potenzial. Aufgrund vorliegender Erkenntnisse ist zu erwarten, dass eine Vielzahl verschiedener Arten von aktivierenden Mutationen (wie auch die Überexpression von RTKs) an der Entstehung oder Progression von Tumoren in Tieren und Menschen beteiligt sind. Die molekulare Identifizierung und Charakterisierung dieser Veränderungen werden nicht nur wichtige Einblicke in fundamentale Mechanismen, welche der Rezeptoraktivierung und der normalen Kontrolle des Wachstums zugrunde liegen, gestatten, sondern können auch zum besseren Verständnis der Krebsentstehung beitragen und darüber hinaus neue Wege für Diagnose und Therapie erschließen. Gegenwärtig werden im Rahmen von Kooperationen mit klinischen Onkologen, dem OncoGenome Labor in Singapur (SOG) und dem Biotechnologieunternehmen U3 Pharma AG eine Reihe von Krebsarten im Hinblick auf Abnormitäten in ihren RTK-Signalsystemen untersucht. Anhand systematischer Analysen werden Tumorzelllinien und Primärtumore identifiziert und im Zusammenhang mit Krankengeschichten und histologischen Untersuchungen auf ihre Bedeutung für Diagnose und Therapie hin ausgewertet. Die Bestätigung der Relevanz beobachteter Veränderungen in Subpopulationen bestimmter Krebstypen wird dann anhand repräsentativer Tumorzelllinien durch molekulargenetische in vitro Strategien und andere zell- und molekularbiologische Manipulationen erbracht. Derartige Untersuchungen wurden bereits Mitte der achtziger Jahre exemplarisch für HER2/neu-RTK in Mammakarzinomen durchgeführt und führten zur Entwicklung des ersten auf Genomanalyse-basierenden Krebstherapeutikums HERCEPTIN, welches seit 1998 für die Behandlung einer molekular definierbaren Form von Brustkrebs zugelassen ist (Abb. 3).

Neuere Forschungsergebnisse, die Mitte der neunziger Jahre mit der Charakterisierung der Rezeptortyrosinkinase VEGFR2 und der Demonstration einer essenziellen Funktion dieser RTK in der Tumorangiogenese begannen, führten zur Entwicklung eines weiteren Krebsmedikaments, SUTENT, welches Anfang 2006 für die Behandlung des Nierenkarzinoms und einer bestimmten Art von Darmkrebs (GIST) von der FDA zugelassen wurde (Abb. 4).
Die Entwicklung von HERCEPTIN und SUTENT sind exemplarisch für das Leitmotiv der Abteilung Molekularbiologie in der interdisziplinären Forschung zwischen Biologie und Medizin.