Schutz durch das Immunsystem kann die Gesundheit kosten
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für Biochemie
Das Immunsystem
Täglich kommen wir mit fremden Mikroorganismen in Kontakt, denen wir ohne unser Immunsystem hilflos ausgeliefert wären. Dies zeigt sich besonders deutlich bei Patienten mit Immundefizienzen, die an viralen und bakteriellen Infektionen sterben, mit denen ein gesunder Mensch spielend leicht fertig geworden wäre. Um ihre Aufgaben zu unserem Schutz erfüllen zu können, müssen Immunzellen fremde Eindringlinge erkennen und von körpereigenen Substanzen unterscheiden. Zellen der als angeboren bezeichneten Immunantwort tun dies anhand von Rezeptoren, die gezielt fremde, Pathogen-assoziierte molekulare Strukturen erkennen. Diese Erkenntnis wurde 2011 mit dem Nobelpreis ausgezeichnet. Nach der Identifizierung solcher Strukturen bekämpft das angeborene Immunsystem die Eindringlinge; gleichzeitig alarmiert es die B- und T-Zellen des adaptiven Immunsystems. Jede Zelle der adaptiven Immunantwort hat einen Antigenrezeptor, mit dem sie eine spezielle Struktur, das Antigen, entdecken kann. B- und T-Zellen expandieren rasant, sobald sie ihr Antigen erkennen und vom angeborenen Immunsystem die Information erhalten, dass es fremd ist. Die expandierten Zelltypen der adaptiven Immunantwort eliminieren die feindlichen Mikroorganismen nun gezielt mithilfe hochspezialisierter Mechanismen, zum Beispiel durch die Produktion von Antikörpern durch terminal differenzierte B-Zellen, die Plasmazellen.
Signalübertragung in Immunzellen
Die Aktivierung von Zelloberflächenrezeptoren löst in Immunzellen eine Signalübertragungs-Kaskade aus. Dabei wird Information über die Art und das Ausmaß der Aktivierung durch sequenzielle Veränderungen von molekularen Bausteinen (Proteinen) innerhalb der Zellen in den Zellkern übermittelt, wo Transkriptionsfaktoren aktiviert werden. Transkriptionsfaktoren bestimmen, welche genetische Information im Zellkern zur Proteinproduktion angeregt wird. Im Falle einer Infektion müssen zum Beispiel Botenstoffe produziert werden, mit denen Immunzellen andere Zellen auf die Gegenwart von Pathogenen hinweisen. Diese Botenstoffe werden, solange keine Infektion vorliegt, nicht gebraucht und daher auch nicht produziert. Die Fehlregulation solcher Signalwege hat jedoch katastrophale Auswirkungen: Die mangelnde Unterscheidung von fremden und eigenen Strukturen kann zu Autoimmunerkrankungen führen, während die ungebremste Expansion von Immunzellen die Entstehung von Krebs bewirken kann.
Analyse der Signalübertragung durch gezielte Genveränderungen in der Maus
Um die Komplexität der Immunreaktionen bei der Pathogenbekämpfung und bei immunologischen Erkrankungen erfassen zu können, analysieren die Wissenschaftler genetisch veränderte Mäuse. Sie benutzen dabei hochentwickelte Systeme, die es ihnen ermöglichen, bestimmte Signalwege spezifisch in einzelnen Immunzelltypen zu aktivieren oder zu inaktivieren (Abb. 1).
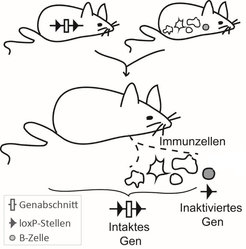
Besonders interessant sind die Signalwege, die zur Aktivierung von NF-κB Transkriptionsfaktoren führen. Eine große Anzahl der für das Immunsystem wichtigen Botenstoffe wird unter der Kontrolle von NF-κB produziert. Diese Proteine haben aber auch eine Schattenseite: Viele menschliche B-Zell -Lymphome, eine Tumorart des Immunsystems, weisen eine starke Aktivierung von NF-κB-Transkriptionsfakoren auf. Bewirkt wird dies durch unterschiedliche genetische Veränderungen in den Tumorzellen, die zu einer Überaktivierung der Signalübertragung zu NF-κB-Proteinen führen. Die Tumorzellen weisen ausnahmslos viele weitere genetische Veränderungen auf, die sie im Laufe ihrer Entwicklung von einer normalen B-Zelle zu einem Lymphom erfahren haben.
Um die Rolle der fehlerhaften NF-κB Aktivierung bei der Lymphom-Entstehung isoliert betrachten zu können, bauen die Forscher die entsprechenden genetischen Veränderungen gezielt in B-Zellen der Maus nach. Die zelltypspezifische, zeitlich regulierbare Veränderung von genetischem Material in der Maus wurde von Zadie Smith im Jahr 2000 in ihrem Roman „Zähne zeigen“ mit dem FutureMouse® Projekt thematisiert. Im Gegensatz zur Fiktion, in der die wertvolle Maus - und mit ihr die wissenschaftliche Erkenntnis - im Getümmel entweicht, konnten die Wissenschaftler hier aber eindeutige Ergebnisse erzielen.
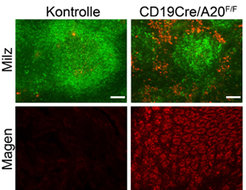
Eine konstitutive Aktivierung der NF-κB-Signalwege durch zwei unterschiedliche genetische Veränderungen führt zu einer dramatischen Erhöhung der B-Zellzahlen, da sie nun quasi unbegrenzt überleben [1,2]. Dies bewirkt eine enorm verstärkte Wahrscheinlichkeit der Lymphom-Entwicklung [3]. Inaktivieren die Forscher dagegen TNFAIP3/A20, ein Regulatorprotein, welches die Signaltransduktion zu NF-κB-Proteinen vermindert und zeitlich begrenzt, zeigt sich ein völlig anderes Bild. Die Anzahl der B-Zellen ist unverändert, aber sie schütten nun in Abwesenheit von fremden Mikroorganismen Botenstoffe aus, die eine Aktivierung von anderen Immunzellen bewirken. Diese chronische Immunaktivierung führt schließlich zur Produktion von Antikörpern gegen körpereigene Strukturen durch dramatisch expandierte Plasmazellzahlen (Abb. 2) [4]. Die Erforschung der zellulären und molekularen Mechanismen, die zu diesem unterschiedlichen Verhalten der B-Zellen führt, ist gegenwärtig ein Fokus der Arbeitsgruppe.
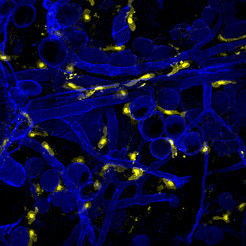
Ähnliche Studien werden mit Fett erkennenden „natürlichen killer“ (NK) T-Zellen und in Mastzellen (Abb. 3), die wichtige Rollen bei entzündlichen und allergischen Reaktionen spielen, durchgeführt.
Regulation durch mRNA-Stabilisierung
Zellen können ihre Proteinausstattung nicht nur durch Aktivierung von Transkriptionsfaktoren regulieren. Diese bewirken das Kopieren des genetischen Materials (DNA) in Boten-RNAs (mRNA), die dann als Anleitung zur Produktion von Proteinen verwendet werden. Auch der Zeitraum, in dem die mRNA als Matrize zur Verfügung steht, ist entscheidend für Menge und Ausmaß der Proteinproduktion und daher streng reguliert. Die Stabilität der mRNA wird über verschiedene Prozesse gesteuert, unter anderem durch mRNA-bindende Proteine. Der Austausch einer einzigen Aminosäure im Protein Roquin erzeugt eine dramatische Autoimmunerkrankung in Mäusen, die dem menschlichen Lupus erythematodes stark ähnelt [5]. Die Wissenschaftler haben die Funktion von Roquin durch zelltypspezifisches Entfernen untersucht. Sie konnten dabei feststellen, dass die Abwesenheit von Roquin zwar eine Immunderegulation, aber keine Autoimmunität verursacht [6]. Man vermutet, dass das veränderte Roquin-Protein auch noch die Funktion eines weiteren, sehr ähnlichen Proteins (Mnab) stört. Dies würde erklären, warum der Aminosäureaustausch in Roquin stärkere Auswirkungen als der Verlust des Proteins hat.
Ausblick
Die vielfältigen Auswirkungen von genetischen Veränderungen auf das komplexe Zusammenspiel von verschiedenen Zelltypen bei normalen Immunantworten und bei immunologischen Erkrankungen lassen sich optimal nur in intakten Organismen studieren. Die Forscher wollen daher zusätzliche, methodisch verbesserte Mausmodelle etablieren und ihre bisherigen Analysen durch moderne Hochdurchsatzverfahren erweitern. Anhand dieser Modelle sollen die molekulargenetischen Grundlagen von Immunantworten und die Auswirkungen fehlgeleiteter Immunantworten studiert werden.


