Die Regulation der zweiten meiotischen Teilung
Forschungsbericht (importiert) 2016 - Max-Planck-Institut für Biochemie
Die Essenz der Reduktion
Die meisten Zellen in Tieren, Pflanzen und Pilzen sind diploid, das heißt, sie enthalten zwei Kopien von jedem Chromosom. Diese Zellen vermehren sich durch normale, mitotische Zellteilungen. Dabei werden die Chromosomen zunächst dupliziert, sodass sie aus jeweils zwei identischen Schwesterchromatiden bestehen, die durch Kohäsine entlang ihrer gesamten Länge zusammengehalten werden. Kohäsine sind Proteinkomplexe aus drei Untereinheiten, die einen Ring bilden, der die Schwesterchromatiden umschließt. Während der Zellteilung werden die Kohäsine an ihrer Kleisin-Untereinheit durch eine als Separase bezeichnete Protease aufgeschnitten, sodass der Spindelapparat die Chromatiden auf die beiden Tochterzellen verteilen kann. Letztlich stammen diese Zellen jedoch von einer einzigen Zelle ab, der Zygote, die durch Verschmelzung von zwei Gameten entstanden ist. Da beide Gameten die gleiche Zahl von Chromosomen zur Zygote beisteuern, müssen sie haploid sein und aus einer speziellen Zellteilung, der Meiose, hervorgehen, bei der die Chromosomenzahl halbiert wird.
Auch die Meiose beginnt mit einer Replikationsphase, in der jedes Chromosom in ein Paar aus Schwesterchromatiden überführt wird (Abb. 1, S-Phase). Danach lagern sich die entsprechenden väterlichen und mütterlichen Chromosomen aneinander und werden im Prozess der Rekombination verknüpft, wobei väterliche und mütterliche Chromatiden kreuzweise miteinander verspleißt werden. Es entstehen „Doppel-Chromosomen“ (Tetraden) in denen die Kohäsine alle vier homologen Chromatiden zusammenhalten (Abb. 1, Prophase I). Die Doppel-Chromosomen werden in den folgenden zwei meiotischen Teilungen wieder in ihre Chromatiden zerlegt: In der ersten meiotischen Teilung (Meiose I) schneidet Separase die Kohäsine auf den Chromosomenarmen aber nicht am Zentromer. Als Folge verteilt die Meiose I-Spindel X-förmige Chromosomen, deren Chromatiden nur noch am Zentromer durch Kohäsine verbunden sind (Abb. 1, Anaphase I). Das Zentromer ist derjenige Chromosomenabschnitt, an den sich die Spindelfasern über einen Proteinkomplex, das Kinetochor, an das Chromatin anheften. Da diese Teilung Kerne produziert, deren Chromosomenzahl auf die Hälfte reduziert ist, wird sie auch Reduktionsteilung genannt. In der zweiten Teilung (Meiose II oder Äquationsteilung) wird schließlich das Kohäsin an den Zentromeren von Separase aufgeschnitten, sodass die Meiose II-Spindel nun die einzelnen Chromatiden voneinander trennen kann (Abb. 1, Anaphase II). Es entstehen vier haploide Zellen, die jeweils eine Chromatide von jedem Chromosom enthalten. Infolge der Rekombination bestehen diese Chromatiden jedoch nun aus unterschiedlichen Kombinationen von mütterlichen und väterlichen Chromatidsegmenten, was die genetische Diversität der Folgegeneration garantiert.
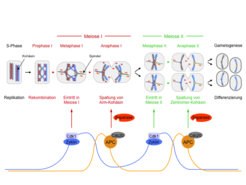
Die Bedingungen, unter denen die Meiose induziert wird, sowie die Entwicklung der Gameten (Eizellen, Spermien oder Sporen) sind in verschiedenen Organismen sehr unterschiedlich. Dagegen wird das Verhalten der Chromosomen durch evolutionär konservierte Prozesse reguliert. Grundlegende Mechanismen der meiotischen Chromosomensegregation können daher in experimentell einfach zu manipulierenden Organismen wie der Bäckerhefe, einem einzelligen Pilz, aufgeklärt werden.
Regulation der Kohäsinspaltung während der Meiose
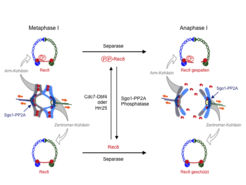
Der Mechanismus der differentiellen Kohäsinspaltung in der Meiose I konnte bereits in früheren Arbeiten mit Hefezellen aufgeklärt werden (Abb. 2). In meiotischen Zellen wird die spaltbare Kohäsinuntereinheit gegen eine meiosespezifische Variante, das Rec8, ausgetauscht. Nur diese Variante kann am Zentromer vor der Spaltung bewahrt werden. Um von Separase erkannt zu werden, muss Rec8 zunächst phosphoryliert werden. In der Hefe geschieht dies durch die konservierten Proteinkinasen Cdc7-Dbf4 und Hrr25 [1]. Am Zentromer wird diese Phosphorylierung jedoch durch die Proteinphosphatase 2A (PP2A) verhindert und damit Rec8 vor der Spaltung bewahrt; PP2A wiederum bindet an Zentromere über das konservierte Shugoshin Protein (Sgo1). Letztlich wird die Kohäsinspaltung also durch den „Kampf“ um die Phosphorylierung von Rec8 bestimmt. In der Meiose I gewinnen Cdc7-Dbf4 und Hrr25 diesen Kampf auf den Chromosomenarmen, verlieren ihn aber an den Zentromeren, da PP2A hier durch Sgo1 konzentriert wird. Es war bislang nicht bekannt, welche Kinase das zentromerische Rec8 in Meiose II phosphoryliert und wie Sgo1 oder PP2A entweder inaktiviert oder vom Zentromer entfernt werden.
Meiose II, eine Kernteilung mit besonderen Aufgaben
Meiose I und Meiose II beginnen jeweils mit der Aktivierung der Zyklin-abhängigen Kinase (Cdk1), die den Aufbau des Spindelapparates induziert und auch für die Aktivität der Ubiquitin-Ligase APCCdc20 nötig ist (Abb. 1, unten). APCCdc20 heftet Ubiquitin an Proteine, die daraufhin degradiert werden. Auf diese Weise bewirkt APCCdc20 die Degradation der Zykline und des Separase-Inhibitors Pds1. Dies führt zur Inaktivierung von Cdk1 beziehungsweise zur Aktivierung von Separase und folglich zum Eintritt in die Anaphase. Die gegenseitige Regulation von Cdk1 und APCCdc20 erzeugt einen Oszillator, der Wellen von Cdk1- und APCCdc20-Aktivität und damit eine Serie von Kernteilungen auslöst. Um eine zusätzliche meiotische Teilung („Meiose III“) zu verhindern, muss die Meiose II einen Mechanismus enthalten, der diesen Oszillator nach genau zwei Wellen ausschaltet. Die Meiose II enthält auch Prozesse, die für die spätere Befruchtung wichtig sind. In männlichen Tieren und Pilzen wird das Programm zur Spermien- beziehungsweise Sporenbildung schon während der Meiose II gestartet. Dagegen aktivieren Säugetieroozyten in der Metaphase II einen APCCdc20-Inhibitor, der den Eintritt in die Anaphase II erst bei der Befruchtung freigibt. Wie die Spaltung des Zentromerkohäsins, die Differenzierung der Gameten und der Austritt aus der Meiose koordiniert werden, war unklar. Dies liegt unter anderem daran, dass die Meiose II experimentell schwierig zu manipulieren ist, da sie kurz auf die Meiose I folgt und wichtige Regulatoren gemeinsam mit der Meiose I hat. Ein genaueres Verständnis der Kontrollmechanismen der Meiose II ist jedoch dringend notwendig, da sich Hinweise mehren, dass ein erheblicher Teil der Chromosomenverteilungsfehler in menschlichen Oozyten ihren Ursprung in der Meiose II haben.
Die Spaltung des Zentromerkohäsins
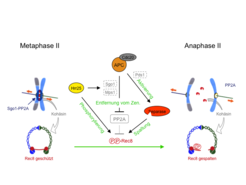
Zur Untersuchung der Meiose II hat die Forschungsgruppe ein neues Synchronisationssystem für Hefe entwickelt. Dabei durchlaufen alle Zellen gleichzeitig die beiden Teilungen und die Meiose II kann ohne Störung der Meiose I manipuliert werden. Es zeigte sich, dass in Meiose II nur eine Kinase, nämlich Hrr25, die Kohäsinuntereinheit Rec8 phosphoryliert, sodass sie von Separase gespalten werden kann. Dies ist jedoch nur möglich, weil die Hrr25 Kinase gleichzeitig ihren Widersacher, die Phosphatase PP2A, vom Zentromer entfernt (Abb. 3). Dabei bewirkt Hrr25, dass Sgo1 und die Kinase Mps1 von APCCdc20 erkannt und für die Degradation markiert werden [2]. Die Mps1 Kinase wird in Meiose II benötigt, damit Sgo1 an Zentromere binden kann. Damit verfügt APCCdc20 über zwei verschiedene Mechanismen, um PP2A vom Zentromer zu entfernen, was diesen Prozess äußerst robust macht. Gleichzeitig aktiviert APCCdc20 die Separase, indem es die Degradation des Inhibitors Pds1 bewirkt. Daraus folgt, dass in Meiose II die Entfernung von PP2A, und damit die Phosphorylierung von Rec8, mit der Aktivierung der Separase gekoppelt sind. Somit wird das Zentromerkohäsin nicht nur während der Meiose I, sondern bis zum Eintritt in die Anaphase II vor der Spaltung durch Separase geschützt. Dies erscheint besonders sinnvoll angesichts der Tatsache, dass die Menge an Pds1 in Metaphase II geringer als in Metaphase I ist und daher die Separase möglicherweise nicht vollständig inhibiert wird.
Ein robuster Mechanismus zum Schutz des Zentromerkohäsins ist besonders wichtig in Säugeroozyten. Nachdem die Ovulation die Meiose I ausgelöst hat, arretieren diese Oozyten in Metaphase II, bis die Befruchtung den Eintritt in die Anaphase II bewirkt. Damit ist das Zentromerkohäsin für längere Zeit bipolaren Spindelkräften ausgesetzt. Wie die Spaltung des Zentromerkohäsins in Oozyten reguliert wird, ist unklar. Es wurde postuliert, dass bipolare Spindelkräfte Sgo-PP2A räumlich von Kohäsin trennen und damit Rec8 der Phosphorylierung und Spaltung durch Separase aussetzen. Da auch in Oozyten die Pds1 Menge in Metaphase II erheblich geringer ist als in Metaphase I, würde ein solcher Mechanismus das Zentromerkohäsin extrem anfällig für vorzeitige Spaltung machen. Dagegen würde der „Hefemechanismus“ das Zentromerkohäsin vor Separase schützen, bis APCCdc20 durch die Befruchtung aktiviert wird.
Verteilen und Verpacken
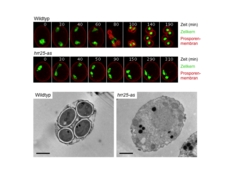
Über die Chromatidentrennung hinaus ist Hrr25 auch essentiell für die Sporenbildung, das Hefependant zur Gametogenese, und den Austritt aus der Meiose [2]. Die Sporenbildung beginnt mit der Synthese der Prosporenmembran, die die einzelnen Kerne während der Anaphase II umhüllt und später bestimmt, wo die Sporenwände entstehen (Abb. 4). Prosporenmembranen gehen von den sogenannten meiotischen Plaques aus, die durch Rekrutierung mehrerer meiosespezifischer Proteine zu den Spindelpolen entstehen. Die Assemblierung dieser Strukturen und damit der erste Schritt der Sporenbildung werden von Hrr25 bereits in der Metaphase II ausgelöst.
Damit sich die Prosporenmembranen um die Kerne schließen können, müssen nicht nur die Chromatiden getrennt, sondern auch die Spindeln abgebaut werden, was mit dem Austritt aus der Meiose II einhergeht. Hrr25 induziert den Austritt aus der Meiose, indem es die Degradation wichtiger Regulatoren der Kernteilung auslöst und gleichzeitig deren Synthese abschaltet. Dies führt zu einer irreversiblen Inaktivierung der Kernteilungsmaschinerie. Zum Beispiel löst Hrr25 nicht nur die Degradation der Zykline durch APCCdc20 aus, sondern aktiviert auch die meiosespezifische Ubiquitin-Ligase APCAma1, die den Abbau des Transkriptionsfaktors für Zyklingene bewirkt. Die Chromatidentrennung, die Synthese der Prosporenmembran und der Austritt aus der Meiose sind voneinander unabhängige Prozesse, deren Koordination für die Bildung lebensfähiger Sporen unerlässlich ist. Dies wird erreicht, indem Hrr25 den jeweils ersten Schritt induziert, sodass die Chromatiden ihre Reise von einer Generation zur nächsten antreten können.



